Fácil y rápido: Descubre cómo calcular el pH de una disolución de manera precisa
El pH es una medida que se utiliza para determinar la acidez o alcalinidad de una sustancia, ya sea líquida o gaseosa. Es una escala logarítmica que va desde 0 hasta 14, siendo 7 el valor considerado neutro. Un pH menor a 7 indica acidez, mientras que un pH mayor a 7 indica alcalinidad. El pH puede tener un impacto significativo en diversos procesos químicos y biológicos, por lo que es importante poder calcularlo con precisión.
Te presentaremos una guía fácil y rápida para calcular el pH de una disolución de manera precisa. Explicaremos los conceptos básicos sobre el pH y cómo se mide, para luego adentrarnos en los diferentes métodos existentes para hacer este cálculo. También te daremos ejemplos prácticos para que puedas aplicar lo aprendido. Ya no tendrás que preocuparte por obtener mediciones poco precisas del pH, ¡sigue leyendo y descubre cómo calcularlo correctamente!
- Qué es el pH y por qué es importante en una disolución
- Cuál es la fórmula para calcular el pH de una disolución
- Cuáles son los pasos necesarios para calcular el pH de una disolución
- Qué instrumentos o reactivos se necesitan para medir el pH de una disolución
- Cómo se interpreta el valor del pH y qué significa cada rango
- Cuáles son los errores comunes al calcular el pH y cómo evitarlos
- Es necesario calibrar los instrumentos de medición del pH y cómo hacerlo correctamente
- Existen métodos alternativos para medir el pH de una disolución sin utilizar instrumentos especializados
- Cómo se puede ajustar el pH de una disolución si es necesario
- Cuáles son las aplicaciones prácticas del conocimiento del pH en diversas industrias
- Preguntas frecuentes (FAQ)
Qué es el pH y por qué es importante en una disolución
El pH es una medida que se utiliza para determinar la acidez o alcalinidad de una disolución. Es un indicador clave en química y puede influir en diversas reacciones químicas y procesos biológicos. El término "pH" proviene del potencial de hidrógeno y se basa en la concentración de iones de hidrógeno presentes en una solución.
El pH se caracteriza por una escala que va desde 0 a 14. Si el pH está por debajo de 7, la disolución se considera ácida; si está por encima de 7, se considera básica o alcalina; y si es igual a 7, se considera neutra. Cada unidad en la escala de pH representa un aumento o disminución de diez veces en la acidez o alcalinidad de la solución.
El conocimiento del pH es importante en diversos campos científicos y aplicaciones cotidianas. En química, el pH puede afectar el desarrollo de reacciones químicas y la estabilidad de las sustancias. Por ejemplo, muchas enzimas tienen rangos de pH óptimos en los cuales su actividad es máxima.
En biología, el pH también desempeña un papel fundamental en la regulación bioquímica y fisiológica de los organismos. Por ejemplo, el pH sanguíneo debe mantenerse dentro de un rango específico para garantizar el buen funcionamiento de los sistemas corporales.
Asimismo, el pH puede ser relevante en aplicaciones prácticas en la vida diaria. Por ejemplo, conocer el pH de una piscina es esencial para mantener una calidad de agua adecuada y evitar problemas de salud. En la industria alimentaria, el pH puede afectar la conservación y sabor de los alimentos. Además, en la agricultura, el pH del suelo puede influir en la disponibilidad de nutrientes para las plantas.
El pH es una medida básica pero esencial para determinar la acidez o alcalinidad de una disolución. Su conocimiento es fundamental en diferentes campos científicos y aplicaciones cotidianas, permitiendo comprender y controlar mejor los procesos químicos y biológicos.
Cuál es la fórmula para calcular el pH de una disolución
Calcular el pH de una disolución puede parecer complicado al principio, pero en realidad es un proceso bastante sencillo si conoces la fórmula adecuada. El pH se utiliza para medir la acidez o basicidad de una solución y se expresa en una escala numérica que va desde 0 hasta 14.
La fórmula general para calcular el pH de una disolución es la siguiente:
pH = -log
Donde representa la concentración de iones hidrógeno en la disolución. Esta concentración se puede determinar mediante diferentes métodos, pero uno de los más comunes es utilizando una ecuación de equilibrio químico conocida como la constante de ionización del agua.
La constante de ionización del agua se representa por el símbolo Kw y su valor a una temperatura de 25°C es de 1 x 10^-14 mol^2/L^2. Esta constante relaciona las concentraciones de iones hidrógeno (H+) e hidróxido (OH-) presentes en el agua pura y se define de la siguiente manera:
Kw =
En una disolución ácida, la concentración de iones hidrógeno (H+) es mayor que la de hidróxido (OH-), lo que significa que el pH es menor a 7. Por otro lado, en una disolución básica, la concentración de hidróxido (OH-) es mayor que la de iones hidrógeno (H+), lo que indica un pH mayor a 7.
Para calcular el pH de una disolución, simplemente debes determinar la concentración de iones hidrógeno (H+) y aplicar la fórmula mencionada anteriormente. Es importante tener en cuenta que la concentración de iones hidrógeno se expresa en moles por litro (mol/L) o en su equivalente molaridad (M).
Existen diferentes métodos para determinar la concentración de iones hidrógeno, como el uso de indicadores de pH, medidores electrónicos de pH y cálculos basados en datos experimentales. Sea cual sea el método utilizado, es importante asegurarse de que los valores utilizados sean precisos y consistentes para obtener resultados confiables.
Calcular el pH de una disolución es un proceso sencillo si conoces la fórmula adecuada y tienes acceso a la concentración de iones hidrógeno. Recuerda que el pH representa la acidez o basicidad de una disolución en una escala numérica del 0 al 14, donde valores menores a 7 indican acidez, valores iguales a 7 indican neutralidad y valores mayores a 7 indican basicidad.
Cuáles son los pasos necesarios para calcular el pH de una disolución
Calcular el pH de una disolución es un proceso esencial en la química analítica. El pH representa el nivel de acidez o alcalinidad de una solución y se determina mediante la concentración de iones de hidrógeno (H+) presentes en esta. Aunque puede parecer complicado, calcular el pH de una disolución es más fácil de lo que crees, y con los pasos correctos podrás obtener resultados precisos de manera rápida y sencilla.
Paso 1: Obtener los materiales necesarios
Antes de comenzar a calcular el pH de una disolución, asegúrate de contar con los materiales necesarios. Necesitarás una balanza analítica para medir las cantidades exactas de los reactivos utilizados, un vaso de precipitados o una probeta para mezclar la solución, una bureta para agregar el reactivo valorante de forma precisa, un pHmetro o papel pH para medir el pH final de la disolución y los reactivos específicos para llevar a cabo el cálculo del pH.
Paso 2: Preparación de la disolución
Una vez que tengas todos los materiales listos, es momento de preparar la disolución. Esto implica medir las cantidades adecuadas de sustancias y disolverlas en el solvente correspondiente utilizando el vaso de precipitados o la probeta. Es importante seguir las indicaciones específicas para cada sustancia y tener en cuenta la estequiometría de la reacción involucrada.
Paso 3: Realización del titulado
El siguiente paso es llevar a cabo el proceso de titulación química. Este método se utiliza para determinar la concentración de una sustancia desconocida a partir de la reacción química con un reactivo valorante de concentración conocida. En el caso del cálculo del pH, este paso implica agregar el reactivo valorante a la disolución hasta que se alcance el punto de equivalencia, donde la cantidad de reactivo añadido es suficiente para neutralizar los iones H+ presentes en la muestra y alcanzar un cambio en el pH.
Paso 4: Medición del pH
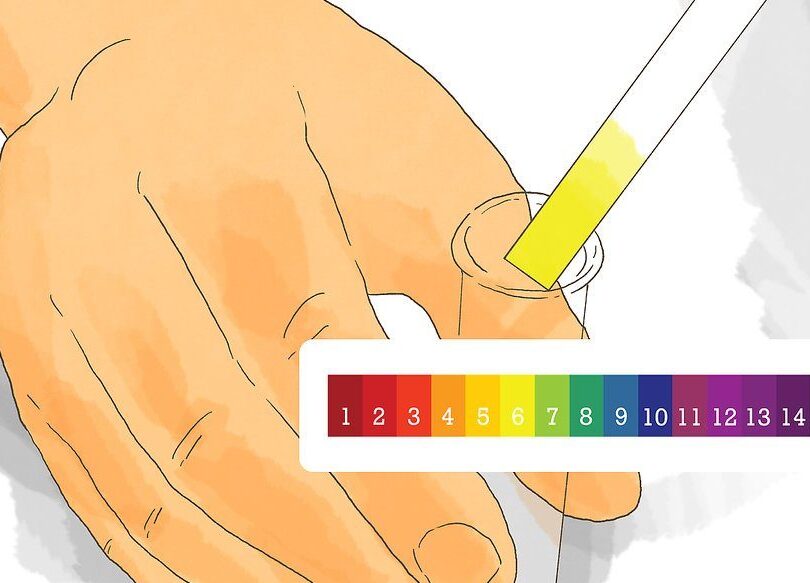
Una vez finalizada la titulación, es necesario medir el pH de la disolución obtenida. Para ello, puedes utilizar un pHmetro o papel pH, dependiendo de la precisión requerida. Un pHmetro es un instrumento que mide directamente el potencial de hidrógeno en la solución y muestra el resultado numérico en una pantalla. Por otro lado, el papel pH es una tira impregnada con sustancias indicadoras que cambian de color según el pH, permitiendo así una estimación visual del nivel de acidez o alcalinidad.
Paso 5: Cálculo del pH
Finalmente, una vez que tienes el valor del pH medido, puedes realizar el cálculo del pH mediante la aplicación de una fórmula específica dependiendo del tipo de disolución y reactivos involucrados. Por ejemplo, si se trata de una disolución ácida, utilizaremos la fórmula del ácido para obtener el pH final. Si es una disolución básica, aplicaremos la fórmula correspondiente.
Calcular el pH de una disolución puede ser una tarea sencilla si se siguen los pasos correctos. Recuerda contar con los materiales necesarios, preparar la disolución con precisión, llevar a cabo un titulado adecuado, medir el pH de la disolución resultante y realizar el cálculo final para obtener el pH exacto. Con práctica y atención a los detalles, podrás realizar este proceso de manera rápida y precisa, obteniendo resultados confiables en tus análisis químicos.
Qué instrumentos o reactivos se necesitan para medir el pH de una disolución
Para medir el pH de una disolución de manera precisa, se requiere contar con algunos instrumentos y reactivos específicos. Estos elementos son fundamentales para llevar a cabo la determinación del grado de acidez o alcalinidad de una solución de forma eficiente y confiable.
1. Medidor de pH
El medidor de pH es un instrumento indispensable en cualquier laboratorio o estudio donde se realicen mediciones de este tipo. Consiste en un dispositivo electrónico que utiliza un electrodo sensible al pH y se encarga de medir directamente la concentración de iones de hidrógeno presentes en la muestra de la disolución.
Existen diferentes tipos de medidores de pH, desde los más básicos que solo miden el pH hasta los más avanzados que ofrecen funciones de calibración automática, almacenamiento de datos y conectividad a computadoras u otros dispositivos.
2. Electrodos de pH
Los electrodos de pH son componentes esenciales que forman parte del medidor de pH. Generalmente están compuestos por un electrodo de vidrio y uno de referencia. El electrodo de vidrio es el encargado de reaccionar con los iones de hidrógeno presentes en la muestra y generar una señal eléctrica proporcional al pH de la disolución.
Es importante tener en cuenta que los electrodos de pH deben ser calibrados periódicamente para asegurar la precisión de las mediciones. Esto se logra sumergiéndolos en soluciones buffer de pH conocido y ajustando los valores en el medidor correspondiente.
3. Soluciones buffer
Las soluciones buffer son disoluciones de pH conocido que se utilizan para calibrar los electrodos de pH y establecer un punto de referencia. Estas soluciones están compuestas por un ácido débil y su base conjugada, o viceversa, y mantienen el pH prácticamente constante cuando se agregan pequeñas cantidades de ácidos o bases.
Para medir el pH de una disolución, es necesario sumergir el electrodo en la muestra y ajustar el medidor de pH al valor adecuado utilizando las soluciones buffer correspondientes. Esto permitirá obtener resultados más precisos y exactos.
4. Pipetas y matraces
Las pipetas y matraces son instrumentos comunes en un laboratorio y resultan útiles para transferir volúmenes específicos de líquido a la hora de preparar las soluciones buffer o las muestras a medir. Se recomienda utilizar pipetas volumétricas o micropipetas para obtener mediciones precisas y evitar errores en el cálculo del pH.
5. Etiquetas y rotuladores
Aunque pueda parecer un detalle menor, contar con etiquetas y rotuladores adecuados es importante para identificar correctamente las muestras y las soluciones buffer utilizadas. Esto evita confusiones al momento de realizar las mediciones y permite mantener un orden adecuado en el laboratorio.
Medir el pH de una disolución de manera precisa requiere de instrumentos como medidores de pH, electrodos de pH, soluciones buffer, pipetas, matraces y elementos de identificación. Utilizando estos elementos y asegurándose de calibrar y mantener el equipo en buen estado, se podrán obtener resultados confiables y exactos en la determinación del pH de una disolución.
Cómo se interpreta el valor del pH y qué significa cada rango
El pH es una medida que indica la acidez o alcalinidad de una solución. Se representa en una escala numérica que va desde 0 hasta 14, donde 7 es considerado neutro. Un valor de pH menor a 7 indica que la solución es ácida, mientras que un valor mayor a 7 indica que es alcalina.
A continuación, te mostraré qué significa cada rango de valores del pH:
- Ácido extremo (0 - 1): Este rango de valores se encuentra reservado solo para sustancias altamente corrosivas y peligrosas, como por ejemplo, el ácido sulfúrico concentrado.
- Ácido fuerte (2 - 3): Sustancias como el vinagre o el zumo de limón tienen un pH cercano a estos valores, lo que las hace tangiblemente ácidas.
- Ácido moderado (4 - 6): El café negro, la cerveza y algunos alimentos fermentados suelen tener un pH en este rango.
- Neutro (7): Agua pura se considera neutral, ya que su concentración de iones de hidrógeno (H+) y de hidróxido (OH-) es igual.
- Alcalino moderado (8 - 10): Algunos productos de cuidado personal, como el jabón líquido o el bicarbonato de sodio, tienen un pH en este rango.
- Alcalino fuerte (11 - 12): Soluciones como la lejía o el amoníaco son altamente alcalinas y pueden causar irritación o quemaduras en la piel y mucosas.
- Alcalino extremo (13 - 14): Estos valores corresponden a sustancias muy corrosivas y peligrosas, como la sosa cáustica o el hidróxido de potasio en solución concentrada.
Recuerda que el pH es una medida relativa y depende de la temperatura. Además, es importante mencionar que las sustancias ácidas o alcalinas pueden tener efectos diferentes sobre los seres vivos y el medio ambiente, por lo que es fundamental manejarlas con precaución y siguiendo las normas de seguridad establecidas.
Conocer e interpretar los valores del pH te ayudará a tener un mayor control sobre las disoluciones, permitiéndote ajustarlas según tus necesidades y garantizando resultados más precisos en tus experimentos o procesos químicos.
Cuáles son los errores comunes al calcular el pH y cómo evitarlos
Al calcular el pH de una disolución, es común cometer algunos errores que pueden afectar la precisión de los resultados. Estos errores pueden ser causados por diversos factores, como la incorrecta medición de las concentraciones, la falta de calibración de los instrumentos o la elección equivocada de los indicadores de pH. A continuación, veremos cuáles son los errores más comunes y cómo evitarlos para obtener cálculos precisos.
1. Error en la medición de las concentraciones
Uno de los errores más comunes al calcular el pH de una disolución es medir incorrectamente las concentraciones de los componentes. Es importante utilizar instrumental adecuado y seguir las instrucciones del fabricante para realizar estas mediciones de forma precisa. Además, se recomienda realizar múltiples mediciones y promediar los resultados obtenidos para minimizar el margen de error.
2. Falta de calibración de los instrumentos
Para obtener resultados precisos al calcular el pH, es fundamental calibrar correctamente los instrumentos de medición, como el pHmetro. La falta de calibración puede llevar a lecturas inexactas y, por lo tanto, a un cálculo erróneo del pH. Se recomienda seguir las instrucciones del fabricante para calibrar el equipo antes de su uso y realizar calibraciones periódicas para garantizar mediciones precisas.
3. Elección equivocada de los indicadores de pH
Los indicadores de pH son sustancias que cambian de color en función del pH de la solución. Sin embargo, es importante elegir el indicador adecuado para la gama de pH en la cual se va a trabajar. Utilizar un indicador inadecuado puede generar lecturas imprecisas e interferir en el cálculo del pH. Se recomienda consultar tablas o guías de referencia para seleccionar el indicador más adecuado según el rango de pH esperado.
4. Error en la interpretación de los resultados
Un error común al calcular el pH es cometer errores en la interpretación de los resultados. Es importante recordar que el pH es una medida logarítmica, lo que significa que los cambios en el valor de pH representan diferencias significativas en la acidez o alcalinidad de la solución. Es fundamental comprender cómo interpretar los resultados correctamente y evitar cometer errores al realizar el cálculo del pH.
5. No considerar factores externos
A veces, al calcular el pH de una disolución, se pueden pasar por alto factores externos que pueden influir en el resultado. Por ejemplo, la temperatura puede afectar la precisión de las mediciones de pH. Es importante tener en cuenta estos factores y, si es necesario, corregir los cálculos en función de ellos para obtener resultados más precisos.
Al calcular el pH de una disolución, es importante tener en cuenta los errores comunes y tomar medidas para evitarlos. La correcta medición de las concentraciones, la calibración de los instrumentos, la elección adecuada de los indicadores de pH, la interpretación correcta de los resultados y la consideración de factores externos son aspectos fundamentales para obtener cálculos precisos del pH. Siguiendo estos consejos, podrás calcular el pH de manera fácil y rápida con resultados más precisos.
Es necesario calibrar los instrumentos de medición del pH y cómo hacerlo correctamente
La precisión en la medición del pH es fundamental para obtener resultados confiables en cualquier tipo de análisis químico. Los instrumentos más comunes utilizados para medir el pH son los medidores de pH, que pueden ser tanto digitales como analógicos.
Estos medidores deben calibrarse periódicamente para garantizar su exactitud y obtener mediciones precisas. La calibración de un medidor de pH consiste en ajustar sus valores de referencia utilizando soluciones conocidas de pH.
Existen diferentes métodos para calibrar un medidor de pH, pero uno de los más utilizados es el método de dos puntos. Este método implica la calibración del medidor en dos puntos extremos: pH 4 y pH 7 (o pH 10, dependiendo del rango de medición del instrumento).
Calibración del medidor de pH utilizando soluciones de pH conocido
- Preparar las soluciones de pH conocido: Para la calibración de dos puntos, es necesario preparar al menos dos soluciones de pH conocido. Estas soluciones se pueden adquirir comercialmente o preparar en el laboratorio utilizando reactivos químicos adecuados. Es importante asegurarse de que las soluciones de pH conocido tengan una concentración adecuada y estén correctamente etiquetadas.
- Limpiar el electrodo del medidor de pH: Antes de comenzar la calibración, es importante limpiar el electrodo del medidor de pH para asegurar mediciones precisas. El electrodo puede limpiarse sumergiéndolo en una solución de limpieza o enjuagándolo con agua destilada.
- Sumergir el electrodo en la solución de pH 7: Una vez limpio, se debe sumergir el electrodo del medidor de pH en la solución de pH 7. Se recomienda esperar un tiempo suficiente para que el electrodo se estabilice y pueda tomar mediciones precisas.
- Ajustar el valor de referencia del medidor de pH: Una vez que el electrodo está sumergido en la solución de pH 7, se debe ajustar el valor de referencia del medidor de pH para que muestre el valor correcto de pH 7. Esto se puede hacer utilizando los controles o botones de ajuste del medidor. Es importante seguir las instrucciones específicas del fabricante para realizar este ajuste correctamente.
- Sumergir el electrodo en la solución de pH conocido adicional: Después de haber ajustado el pH 7, se debe sumergir el electrodo en la segunda solución de pH conocido (pH 4 o pH 10). Al igual que en el paso anterior, es necesario esperar un tiempo suficiente para que el electrodo se estabilice y luego ajustar el valor de referencia del medidor de pH para que muestre el valor correcto de pH en esta solución.
- Verificar la precisión del medidor de pH: Una vez que se ha realizado la calibración en ambos puntos, se debe verificar la precisión del medidor de pH realizando mediciones adicionales en soluciones de pH conocido. El medidor debe mostrar valores cercanos a los pH esperados para cada solución. En caso de encontrar diferencias significativas, se recomienda volver a calibrar el medidor utilizando una solución de pH conocido adicional.
Es importante recalibrar el medidor de pH regularmente, especialmente si se utiliza con frecuencia o si se va a utilizar en aplicaciones críticas donde la precisión es crucial. Además, es fundamental seguir las instrucciones del fabricante del medidor de pH y utilizar soluciones de pH conocido de calidad para obtener los mejores resultados en la calibración.
La calibración de los instrumentos de medición del pH es esencial para obtener mediciones precisas y confiables. El método de dos puntos es uno de los más comunes y se basa en la calibración en soluciones de pH 4 y pH 7 (o pH 10). Siguiendo los pasos adecuados y utilizando soluciones de calidad, se puede garantizar una calibración precisa y resultados confiables en cualquier análisis químico.
Existen métodos alternativos para medir el pH de una disolución sin utilizar instrumentos especializados
Medir el pH de una disolución es una tarea común en química y ciencia de los materiales. Normalmente, se utilizan medidores específicos como el pHmetro para obtener resultados precisos y confiables. Sin embargo, existen ocasiones en las que no contamos con estos instrumentos especializados a la mano.
Afortunadamente, existen métodos alternativos que nos permiten estimar el pH de una disolución de manera precisa utilizando elementos cotidianos que todos tenemos al alcance. Estos métodos pueden ser especialmente útiles cuando necesitamos una aproximación rápida o cuando estamos realizando experimentos en lugares remotos o de difícil acceso.
1. Papel de tornasol
Uno de los métodos más simples y conocidos para determinar el pH de una disolución es utilizando papel de tornasol. Este papel contiene indicadores ácido-base que cambian de color según el pH del medio en el que se sumergen.
Para utilizarlo, simplemente debemos sumergir una tira de papel de tornasol en la disolución que deseamos analizar. Observaremos un cambio de color en la tira que nos indicará si la solución es ácida, básica o neutra.
Es importante tener en cuenta que el papel de tornasol ofrece una indicación cualitativa del pH, es decir, nos dice si la solución es ácida, básica o neutra, pero no nos brinda una medida numérica exacta. Es ideal para determinar de forma rápida si una solución está dentro de un rango específico de pH.
2. Jugo de repollo morado
Otro método casero para determinar el pH de una disolución es utilizando jugo de repollo morado como indicador ácido-base natural. El repollo morado contiene un pigmento llamado antocianina, que cambia de color según el pH del medio en el que se encuentra.
Para utilizarlo, debemos extraer el jugo de repollo morado y agregar unas gotas a la disolución que deseamos analizar. Observaremos un cambio de color en función del pH: si la solución tiene un pH ácido, el jugo se volverá rojo; si la solución tiene un pH básico, el jugo se volverá verde o azul. Este método también nos brinda una indicación cualitativa del pH.
3. Vinagre y bicarbonato de sodio
Este método es una variante del clásico experimento de reacción química entre vinagre y bicarbonato de sodio. Al combinar estas dos sustancias, se produce una efervescencia debido a la liberación de dióxido de carbono.
Si la disolución que deseamos analizar es ácida, el vinagre actuará como un ácido débil y no habrá un cambio significativo en la efervescencia. Sin embargo, si la disolución es básica, el bicarbonato de sodio actuará como una base y generará una efervescencia notoria.
Es importante mencionar que este método solo nos indica si la disolución es ácida o básica, pero no ofrece una medida precisa del pH.
4. Litmus paper
El papel litmus es otro indicador ácido-base muy utilizado en química. Este papel está impregnado con una sustancia que cambia de color según el pH del medio.
Para utilizarlo, simplemente debemos sumergir una tira de papel litmus en la disolución que deseamos analizar. Observaremos un cambio de color en la tira que nos indicará si la solución es ácida o básica.
Es importante tener en cuenta que el papel litmus también ofrece una indicación cualitativa del pH, por lo que no nos brinda una medida numérica exacta.
Aunque los métodos alternativos para medir el pH de una disolución pueden no ser tan precisos como utilizar instrumentos especializados, son útiles en situaciones en las que no disponemos de estos equipos o cuando necesitamos una estimación rápida. Es importante recordar que estos métodos solo nos brindan una indicación cualitativa del pH y no una medida numérica precisa. Si se requiere una determinación exacta del pH, es recomendable utilizar un pHmetro u otros instrumentos adecuados.
Cómo se puede ajustar el pH de una disolución si es necesario
El ajuste del pH de una disolución es un proceso importante en química para asegurar que la solución tenga el valor de acidez o basicidad adecuado para su aplicación. Hay muchas situaciones en las que puede ser necesario ajustar el pH de una disolución, ya sea para fines científicos, industriales o incluso domésticos.
Para ajustar el pH de una disolución, existen diferentes métodos y técnicas disponibles que permiten modificar el valor del pH de una manera precisa y controlada. A continuación, te presentaremos algunas opciones comunes:
Uso de ácidos o bases: Uno de los métodos más sencillos para ajustar el pH es agregando cuidadosamente ácidos o bases a la solución. Si se desea disminuir el pH de una disolución, se puede agregar ácido, mientras que si se quiere aumentar el pH, se puede añadir base. Este método es ampliamente utilizado debido a su simplicidad y efectividad.Utilización de indicadores de pH: Los indicadores de pH son sustancias que cambian de color dependiendo del pH de una solución. Estos son especialmente útiles cuando se necesita ajustar el pH dentro de un rango específico. Al agregar un indicador de pH a la disolución, podemos ir monitoreando visualmente el cambio de color y realizar ajustes hasta obtener el valor deseado.Uso de sistemas de titulación: La titulación es un método más preciso para ajustar el pH, especialmente cuando se requiere una precisión exacta. Consiste en la adición gradual y controlada de una solución de ácido o base conocida en la disolución, hasta alcanzar el punto de equivalencia y obtener el pH deseado. Este método requiere de un indicador de pH y un bureta para añadir la solución titulante de manera controlada.Aplicación de técnicas electroquímicas: Las técnicas electroquímicas, como la electrolisis o la electroforesis, también pueden utilizarse para ajustar el pH de una disolución. Estas técnicas involucran el uso de corriente eléctrica para generar cambios en la acidez o basicidad de la solución.
Es importante tener en cuenta que, al ajustar el pH de una disolución, se debe realizar con precaución y siguiendo todas las normas de seguridad correspondientes. Además, es recomendable utilizar instrumental adecuado y contar con conocimientos básicos sobre propiedades ácido-base.
El ajuste del pH de una disolución es una tarea fundamental en muchos aspectos de la química. Existen diversas formas de lograrlo, desde el empleo de ácidos o bases, hasta la aplicación de técnicas más avanzadas como la titulación o las técnicas electroquímicas. En cualquier caso, es esencial tener cuidado y seguir los protocolos adecuados para garantizar resultados precisos y seguros.
Cuáles son las aplicaciones prácticas del conocimiento del pH en diversas industrias
El conocimiento del pH y la capacidad de calcularlo de forma precisa tienen numerosas aplicaciones prácticas en diversas industrias. El pH es una medida que nos indica el grado de acidez o alcalinidad de una solución, y su control es fundamental en muchos procesos industriales.
Industria alimentaria
En la industria alimentaria, el control del pH es esencial para garantizar la seguridad y calidad de los productos. Por ejemplo, en la fabricación de bebidas como los refrescos o jugos, se ajusta el pH para asegurar el sabor óptimo y la durabilidad del producto. Además, en la elaboración de alimentos fermentados como el yogur o el queso, se requiere un control preciso del pH para favorecer la actividad de las bacterias benéficas y evitar el crecimiento de microorganismos no deseados.
Industria farmacéutica
En la industria farmacéutica, el control del pH es crucial para garantizar la estabilidad y eficacia de los medicamentos. Muchos fármacos son sensibles a variaciones en el pH, por lo que es necesario medir y ajustar cuidadosamente el pH de las soluciones empleadas en la formulación de los medicamentos. Además, la acidez o alcalinidad de ciertos medicamentos puede influir en su absorción en el organismo, por lo que el control del pH también es importante para asegurar su correcto funcionamiento.
Industria química
En la industria química, el conocimiento del pH es esencial en numerosos procesos. Por ejemplo, en la fabricación de productos químicos como los fertilizantes o los productos de limpieza, se debe controlar cuidadosamente el pH para obtener resultados óptimos. Además, en la industria de galvanoplastia, donde se realizan recubrimientos metálicos mediante procesos electroquímicos, el control del pH es fundamental para asegurar la calidad y uniformidad de los recubrimientos.
Industria ambiental
En la industria ambiental, el conocimiento del pH es importante en el monitoreo y tratamiento de aguas residuales. El control del pH en las plantas de tratamiento de aguas cumple un papel crucial en la eliminación de contaminantes y evita el impacto negativo en los ecosistemas acuáticos. Asimismo, en la agricultura, el control del pH del suelo es vital para el crecimiento adecuado de las plantas, ya que influye directamente en la disponibilidad de nutrientes para las raíces.
El conocimiento y cálculo preciso del pH tienen un papel fundamental en diversas industrias. Su control afecta desde la calidad y seguridad de los alimentos hasta la eficacia de los medicamentos y los procesos químicos. Además, es clave para garantizar la salud de los ecosistemas acuáticos y el crecimiento adecuado de las plantas. Por tanto, entender y manejar el pH se convierte en una habilidad indispensable en el ámbito industrial.
Preguntas frecuentes (FAQ)
1. ¿Qué es el pH de una disolución?
El pH es una medida que indica la acidez o alcalinidad de una solución. Se mide en una escala de 0 a 14, donde 7 es neutral, valores por debajo indican acidez y valores por encima indican alcalinidad.
2. ¿Cómo se calcula el pH de una disolución?
El pH se calcula usando la fórmula: pH = -log, donde es la concentración de iones hidrógeno presentes en la solución. Esta concentración puede determinarse experimentalmente o ser conocida si se conoce la cantidad de ácido o base añadida a la solución.
3. ¿Cuáles son los factores que afectan el pH de una disolución?
El pH de una disolución puede verse afectado por varios factores, como la concentración de ácidos o bases presentes, la temperatura, la presencia de sales o sustancias ionizables y reacciones químicas que ocurren en la solución.
4. ¿Cuál es el rango de pH considerado seguro para el consumo humano?
El rango de pH considerado seguro para el consumo humano en general se encuentra entre 6 y 8. Valores fuera de este rango pueden tener efectos negativos en la salud, siendo los extremos más ácidos o alcalinos los más perjudiciales.
5. ¿Cómo puedo medir el pH de una disolución en casa?
Existen kits de pruebas de pH que se pueden usar en casa para medir el pH de una disolución. Estos kits generalmente contienen tiras reactivas impregnadas con sustancias indicadoras de pH que cambian de color según el pH de la solución.
